Sisu
Massi säilitamise seaduse kohaselt ei saa ainet keemilises reaktsioonis tekitada ega hävitada, nii et välja tulevad tooted peavad olema ekvivalentsed reagentidega, mis olid alguses olemas. Teisisõnu, iga sisestatud aatomi kogus peab samuti välja tulema. Stöhhiomeetria on nende elementide analüüs ja hõlmab arvutusi, milles võetakse arvesse reagentide ja toodete masse antud keemilises reaktsioonis. Stöhhiomeetria hõlmab natuke matemaatikat ja natuke keemiat ning põhineb ülaltoodud ühel põhimõttel: seda ainet ei võideta ega kaotata kunagi keemilise reaktsiooni käigus. Mis tahes keemilise probleemi lahendamise esimene samm on võrrandi tasakaal.
Sammud
Meetod 1/4: keemilise võrrandi tasakaalustamine

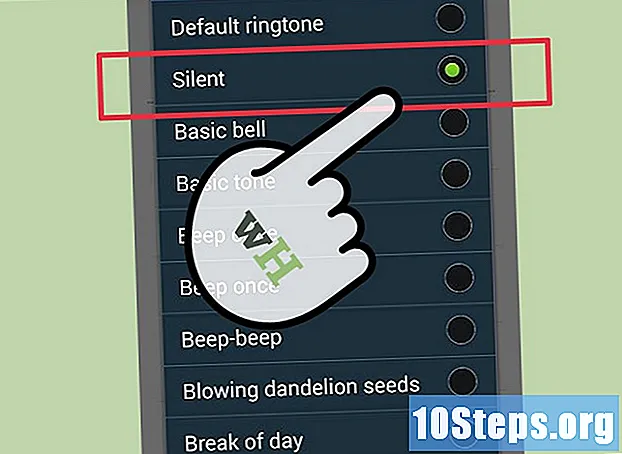
Kirjutage aatomite arv igas ühendis võrrandi mõlemale küljele. Keemilise võrrandi kaudu on võimalik kindlaks teha aatomi kogus võrrandi igas elemendis. Kuna selles sisalduvat ainet pole võimalik luua ega hävitada, on võrrand tasakaalust väljas, kui mõlemal küljel olevate aatomite arv (ja tüübid) pole täiesti võrdsed.- Ärge unustage vajadusel korrutada koefitsiendiga või tellitud väärtusega.
- Näiteks:
- Reaktiivi küljel (vasakul) on kaks vesinikuaatomit, väävliaatom, neli hapnikuaatomit ja rauaaatom.
- Toote küljel (paremal) on kaks vesinikuaatomit, kolm väävliaatomit, hapnikuaatomit ja kaks rauaatomit.

Mõlema külje tasakaalustamiseks asetage koefitsient muude elementide ette peale hapniku ja vesiniku. Tehke kindlaks kõigi elementide, välja arvatud hapniku ja vesiniku, minimaalne ühistegur, et saada mõlemalt küljelt võrdsed aatomite kogused.- Näiteks on minimaalne ühine tegur kahe ja ühe vahel kaks kuni. Asetage üks vasakul küljel selle tasakaalustamiseks.
- Minimaalne ühine tegur kolme ja ühe vahel on kolm kuni. Asetage üks ees mõlema poole tasakaalustamiseks.
- Sel hetkel näeb võrrand välja järgmine:

Tasakaalu hapniku ja vesiniku aatomid. Need kaks elementi on tasakaalus viimati, kuna need esinevad tavaliselt paljudes molekulides võrrandi mõlemal küljel. Tasakaalu hetkel ärge unustage aatomite loendamist uuesti, kui panete molekulidele koefitsiendid.- Näites pandi üks ette ja nüüd on vasakul kuus vesinikuaatomit, võrrandi paremal küljel on ainult kaks. Vasakul on ka hapnikuaatomid ja paremal hapnikuaatomid, mille kohta võib öelda, et see on tasakaalus.
- Vesinikke on võimalik tasakaalustada, lisades vesiniku ette.
- Lõplik tasakaalustatud võrrand kirjutatakse järgmiselt:
Loendage aatomite arv võrrandi mõlemal küljel uuesti, et veenduda nende tasakaalus. Pärast lõpetamist on alati kasulik tagasi algusesse minna ja võrrandi tasakaalu kontrollida. Seda saab teha, lisades kõik võrrandi mõlemal küljel olevad aatomid uuesti, et näha, kas väärtused vastavad.
- Pange tähele näite võrrandit:
- Noolt vasakul on kuus vesinikuaatomit, kolm väävliaatomit, hapnikuaatomit ja kaks rauaatomit.
- Noolt paremal on kaks rauaaatomit, kolm väävliaatomit, hapnikuaatomid ja kaheksa vesinikuaatomit.
- Võrrandi vasak ja parem külg liituvad ja seetõttu võib öelda, et need on tasakaalus.
2. meetod 4-st: teisendamine grammide ja moolide vahel
Arvutama molaarmass grammides ühendit. Molaarmass tähistab kõnealuse ühendi ühe mooli kogust grammides (). See võimaldab hõlpsalt muundada aine grammi ja mooli vahel. Molaarmassi arvutamiseks peate lisaks nende kummagi aatommassile tuvastama, kui palju ühendis on konkreetse elemendi molekule.
- Määratlege ühendi iga elemendi aatomite arv. Näiteks glükoos väljendatakse kujul, nii et seal on kuus süsinikuaatomit, kaksteist vesinikuaatomit ja kuus hapnikuaatomit.
- Tuvastage aatomi mass grammides ühe aatomi mooli kohta. Iga elemendi mass osutatakse perioodilise tabeli vastava sümboli alla, tavaliselt koma. Glükoosis sisalduvate elementide aatommassid on:
- Korrutage iga elemendi aatommass ühendi aatomite arvuga:
- Nende saaduste lisamisel saadakse ühendi molaarmass.
Glükoosi ühe mooli mass on võrdne.
Teisendage grammi ainet molaarmassi abil moolideks. Kasutades seda ümberarvestustegurina, on võimalik arvutada mooli kogus antud ühendi analüüsitud grammides. Jaga teadaolev kogus grammides () molaarmassiga (). Lihtne viis teada saada, kas arvutus oli õige, on kontrollida, kas üksused tühistavad üksteise, jättes järele vaid mutid.
- Näiteks: mitu mooli on grammides vesinikkloriidi ()?
- Vesiniku aatommass on grammides ja kloori grammides, seega saadakse ühendi molaarmass.
- Kui aine kogus grammides jagatakse molaarmassiga, saadakse:.
Määrake reagentide molaarsuhe. Produkti saagise kindlaksmääramiseks teatud reaktsioonis on vaja kindlaks määrata molaarsuhe. See ütleb teile, millised ained reageerivad teistele, arvestades tasakaalustatud võrrandis sisalduvate elementide koefitsienti.
- Milline on näiteks moolsuhe keemilises võrrandis?
- Esiteks pange tähele, et võrrand on tasakaalus. Ärge kunagi unustage seda sammu, vastasel juhul on proportsioonid valed. Sel juhul on mõlemal küljel mõlemal elemendil võrdsed osad ja seetõttu peetakse võrrandit tasakaalustatuks.
- Suhe on võrdne. Pole tähtis, millised väärtused on lugejas ja nimetajas, kui need püsivad kogu probleemi vältel ühes ja samas positsioonis.
Rist korrutage teise reagendi moolide määramiseks molaarsuhte järgi. Teatud reaktsioonis toodetud või vajaliku aine moolide hulga arvutamiseks kasutatakse moolsuhet.Probleemid paluvad teil tavaliselt kindlaks määrata vajaminevate või toodetud moolide kogus vastavalt kindlale kogusele grammi reagenti.
- Näiteks kui arvestada võrrandit, siis mitu mooli tekib grammides reageerides piisavas koguses?
- Näites esindab see piisav kogus seda, mis on vajalik, seega pole probleemi lahendamisel oluline arvestada selle võimaliku väärtusega.
- Esiteks teisendage moolide kogus grammides. Lämmastiku aatommass on võrdne, nii et selle molaarmass on võrdne. Massi jagamisel molaarmassiga saadakse moolid.
- Määrake ülesande antud proportsioonid:.
- Korrutage suhe korrutatuna molaarsuhtega, mis on:
Aine molaarmassi abil teisendatakse moolides olev kogus massiks tagasi. Moolide massiks grammidesse teisendamiseks kasutate molaarmassi uuesti ja nüüd, korrutades. Ärge unustage kasutada õiget molaarmassi.
- Molaarmass on võrdne. Varsti alates.
3. meetod 4-st: liitrite gaasi ja moolide muundamine
Tehke kindlaks, kas reaktsioon toimub normaalse temperatuuri ja rõhu (CNTP) tingimustes. See on tingimuste kogum, mille korral ideaalne gaasi mool võtab liitrit () ruumala. Normaaltemperatuur on sel juhul võrdne Kelviniga (), samas kui normaalrõhk on samaväärne atmosfääriga ().
- Üldiselt tähistab reaktsiooni, mis toimub rõhul ja temperatuuril, ainult akronüümiga CNTP.
Gaasi liitrite moolideks teisendamiseks kasutage ümberarvestustegurit. Kui reaktsioon toimub CNTP-ga, saate antud gaasi mahu moolide hulga arvutamiseks kasutada väärtust. Soovitud tulemuse saamiseks jagage see väärtus liitrites () ümberarvestuskoefitsiendiga.
- Näiteks teisendage liitrid gaasi moolideks:
- Näiteks teisendage liitrid gaasi moolideks:
Gaasi liitrite konverteerimiseks, mis ei kuulu CNTP alla, kasutage ideaalse gaasi seadust. Erinevates tingimustes reaktsiooniga töötades peate reaktsioonis esinevate moolide hulga määramiseks kasutama ideaalse gaasi seadust (). tähistab rõhku atmosfääris, gaasi mahtu liitrites, aine moolide kogust, gaasi konstanti () ja temperatuuri kelvinites.
- Summa moolides määramiseks võib võrrandit ümber korraldada:.
- Gaasikonstandi ühikuid kasutatakse võrrandi muude muutujate tühistamiseks.
- Näiteks määrake moolide kogus liitrites a ja. Sisestades muutujad nende positsioonidesse, on meil järgmine:
4. meetod 4-st: liitrite vedelike ja moolide muundamine
Arvutama tihedus vedelikust. Mõnel juhul annavad keemilised võrrandid reaktiivi vedeliku mahu ja küsivad selle koguse suurust grammides või moolides, et reaktsioon toimuks. Grammidesse teisendamiseks tuleb kasutada tihedust, muutujat, mis koosneb massist jagatuna ruumalaga.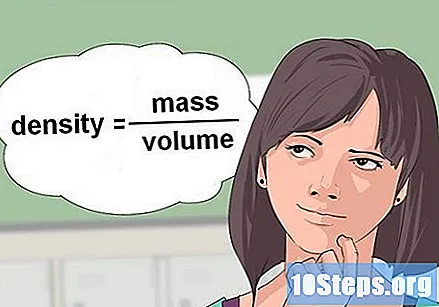
- Kui tihedust probleemis ei antud, võib olla vajalik selle väärtust kontrollida võrdlustabelis või Internetis.
Teisendage maht milliliitritesse (). Vedeliku mahu teisendamiseks massiks () peate kasutama selle tiheduse väärtust. See muutuja on esitatud grammides milliliitri kohta, seega peab vedeliku maht muundamiseks olema milliliitrites.
- Tuvastage antud maht. Oletame näiteks probleemi, mis näitab, et teil on liitrit. Selle väärtuse teisendamiseks korrutage see lihtsalt väärtusega, kuna liitris vees on milliliitreid.
Korrutage maht tihedusega. Kui korrutate ruumala () vedeliku tihedusega (), tühistatakse milliliitrid ja teile jääb alles kõnealuse aine gramm.
- Näiteks tihedus on. Kui teie keemilises võrrandis on esitatud andmed, võrdub kogus grammides grammidega.
Arvutama molaarmass reagent. See tähistab analüüsitava ühendi mooli kogust grammides () lisaks sellele, et saate hõlpsalt konverteerida nende kahe ühiku vahel. Molaarmassi arvutamiseks peate lisaks kõigi selles esinevate elementide aatommassile tuvastama, mitu antud molekuli molekuli teatud ühendis on.
- Määratlege ühendis sisalduva iga elemendi aatomite arv. Näiteks glükoosis () on kuus süsinikuaatomit, vesinikuaatomit ja kuus hapnikuaatomit.
- Tuvastage aatomi mass grammides ühe aatomi mooli kohta. Iga glükoosis sisalduva elemendi aatommassid on:
- Tuvastage aatomi mass grammides ühe aatomi mooli kohta. Glükoosis sisalduvate elementide aatommassid on:
- Nende saaduste lisamisel saadakse ühendi molaarmass.
Glükoosi ühe mooli mass on võrdne.
Teisendage grammi ainet moolideks moolideks. Kasutades seda ümberarvestuskoefitsiendina, saate arvutada moolide koguse, mis on määratud aine grammides. Jaga teadaolev kogus grammides () molaarmassiga (). Lihtne viis vaadata, kas arvutus tehti õigesti, on kontrollida, kas ühikud tühistati, jättes alles vaid moolid.
- Näiteks: kui palju mooli on vesinikkloriidis ()?
- Aatommass é ja é on, mille tulemusel saadakse ühendi mass.
- Aine koguse grammides jagamine molaarmassiga annab tulemuseks mooli.